temas eduacitivos
viernes, 4 de enero de 2013
jueves, 1 de noviembre de 2012
Leucemia
Leucemia
Saltar a: navegación, búsqueda
| Leucemia | |
|---|---|
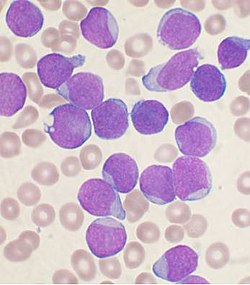 Frote sanguíneo de precursores linfocíticos en una Leucemia linfoide aguda (LLA). |
|
| Clasificación y recursos externos | |
| CIE-10 | C95 |
| CIE-9 | V10.6 |
| CIAP-2 | B73 |
| DiseasesDB | 7431 |
| MedlinePlus | 001299 |
| PubMed | Buscar en Medline mediante PubMed (en inglés) |
Índice |
Epidemiología
La leucemia es el cáncer más frecuente en la infancia, con 9-10 casos por año por cada 100.000 niños menores de 15 años.3 En el año 2000, unos 256.000 niños y adultos desarrollaron algún tipo de leucemia.4Clasificación
Existen distintos tipos de clasificación, en función del criterio que se utilice para ello.- Según la población celular afectada:
- Leucemia mieloide crónica (LMC) incluida dentro de los síndromes mieloproliferativos crónicos.
- Leucemia linfoide crónica (LLC) incluida dentro de los síndromes linfoproliferativos y equiparable al linfoma linfocítico.
- Leucemia linfoide aguda o Leucemia Linfoblástica Aguda (LLA)5
- Leucemia mieloide aguda o Leucemia Mieloblástica (LMA)
- Leucemia mielógena (LM)
- Según la gravedad de la patología:
- Aguda: en este caso, se da un aumento muy rápido de las células sanguíneas inmaduras. Estas células no realizan las funciones sanguíneas necesarias, y ocupan un espacio que permitiría el desarrollo de las células maduras. Es muy importante que el tratamiento sea precoz ya que la progresión celular y la dispersión de las células malignas puede conducir a que la leucemia llegue a otros órganos corporales. Esta forma de leucemia es la más común en niños.
- Crónica: en esta afección, se producen demasiados glóbulos blancos maduros pero anormales. Progresa durante meses o años, por lo que no siempre se administra el tratamiento inmediatamente, si no que a veces se monitoriza la situación para ver cual es el momento más efectivo para la terapia. Aunque pueden ocurrir en cualquier grupo de edad, la leucemia crónica ocurre más a menudo en personas mayores.
En las leucemias crónicas, la principal característica morfológica es la no existencia de dicho hiato leucémico, ya que no existe stop madurativo, permitiendo secretar a la sangre células maduras, y su curso clínico suele ser indolente.
Cuadro clínico
Se producen daños en la médula ósea, a modo de desplazamientos de las células normales de la médula ósea con un mayor número de glóbulos blancos inmaduros. Todo esto se traduce en una falta de plaquetas en la sangre, fundamentales en el proceso de coagulación sanguínea, por lo que las personas con leucemia pueden desarrollar fácilmente hematomas y un sangrado excesivo o hemorragias punteadas (petequias)Los glóbulos blancos, implicados en la defensa del organismo, pueden ser deficientes o disfuncionales. Esto puede causar que el sistema inmune del paciente sea incapaz de luchar contra una infección simple. Debido a que la leucemia impide que el sistema inmunitario funcione con normalidad, algunos pacientes experimentan infecciones frecuentes, que van desde las amígdalas infectadas, llagas en la boca, diarrea, neumonía o infecciones oportunistas.
Por último, la deficiencia de glóbulos rojos produce anemia, que puede causar disnea y palidez.
De manera resumida, algunas de sus manifestaciones clínicas más importantes son:
- Decaimiento, falta de fuerzas, mareos, náuseas, inapetencia, disminución de peso importante.
- Fiebre que dura varios días sin una causa aparente, sudoración nocturna, escalofríos.
- Dolor o sensibilidad ósea, dolores articulares y de extremidades.
- Hemorragias frecuentes sin motivo aparente, por ejemplo, sangrado anormal de las encías o de la nariz.
- Petequias o hematomas sin haber tenido algún golpe.
- Palidez de piel, interior de la cavidad oral o de los párpados.
- Aumento de tamaño de los ganglios linfáticos.
- Aparición de masas o crecimientos anormales de órganos abdominales como el bazo y el hígado, o aparición de masas que crecen en otras partes del cuerpo.
- Alteraciones de los exámenes sanguíneos (hemograma, VIH, etc.).
- Irregularidad en los ciclos menstruales.
Algunos pacientes con leucemia no tienen una alta cantidad de glóbulos blancos visibles durante un recuento sanguíneo normal. Esta condición menos común se denomina aleucemia. La médula ósea contiene las células cancerosas aún blancas de la sangre que perturban la producción normal de células sanguíneas. Sin embargo, las células leucémicas se alojan en la médula en lugar de entrar en el torrente sanguíneo, donde serían visibles en un análisis de sangre. Para un paciente aleucémico, el recuento de glóbulos blancos en la sangre puede ser normal o baja. La aleucemia puede ocurrir en cualquiera de los cuatro tipos principales de leucemia, y es particularmente común en la leucemia de células pilosas.
Etiología
No hay una única causa conocida para todos los distintos tipos de leucemia que existen. Las causas conocidas, que no son factores intrínsecos de la persona, representan relativamente pocos casos.6 Cada leucemia distinta puede tener varias causas diferentes.La leucemia, al igual que otros tipos de neoplasias, son el resultado de mutaciones del ADN. Ciertas mutaciones producen la activación de oncogenes o la desactivacion de los genes supresores de tumores, y con ello alterar la regulación de la muerte celular, la diferenciación o la mitosis. Estas mutaciones ocurren espontáneamente o como resultado de la exposición a la radiación o a sustancias cancerígenas, además de la probable influencia de factores genéticos.7
Entre los adultos, podemos diferenciar entre los factores biológicos (virus como el virus linfotrópico T humano) y los artificiales (radiación ionizante, benceno, agentes alquilantes y quimioterapia para otras enfermedades).8 9 10 El consumo de tabaco se asocia con un pequeño aumento en el riesgo de desarrollar leucemia mieloide aguda en adultos.8 El uso y la exposición a algunos productos petroquímicos y tintes para el cabello se ha relacionado con el desarrollo de algunas formas de leucemia. También se han descrito casos de transmisión materno-fetal.8
Algunas formas de leucemia están vinculadas a infecciones víricas. Experimentos en ratones y otros mamíferos han demostrado la relación entre los retrovirus y la leucemia y también han sido identificados retrovirus humanos. El primer retrovirus humano identificado fue el virus linfotrópico T humano o HTLV-1, el cual causa la leucemia de células T.11
Algunas personas tienen una predisposición genética hacia el desarrollo de leucemias. Esta predisposición se demuestra por los antecedentes familiares y los estudios en gemelos.8 Los afectados pueden tener un solo gen o genes múltiples en común. En algunos casos, las familias tienden a desarrollar el mismo tipo de leucemia que los demás miembros; en otras familias, las personas afectadas pueden desarrollar formas diferentes de leucemia o neoplasias relacionados con la sangre.8
Además de estas cuestiones, las personas con anomalías cromosómicas o ciertas enfermedades genéticas tienen un mayor riesgo de padecer leucemia.9 Por ejemplo, las personas con síndrome de Down tienen un riesgo significativamente mayor de desarrollar formas de leucemia aguda y la anemia de fanconi es una factor de riesgo de desarrollar leucemia mieloide aguda.
La radiación no ionizante como causa de la leucemia ha sido estudiada durante varias décadas. Los expertos del grupo de trabajo de la Agencia Internacional de Investigaciones sobre el cáncer realizaron una revisión detallada de todos los datos estáticos y de frecuencias extremadamente bajas de energía electromagnética, que se produce de forma natural y en asociación con la generación, transmisión y uso de la energía eléctrica.12 Llegaron a la conclusión de que hay muy pocas pruebas de que altos niveles de campos magnéticos ELF (pero que no sean eléctricos) podrían causar leucemia infantil. La exposición a campos magnéticos de ELF significativa podría dar lugar a un doble riesgo excesivo para la leucemia de los niños expuestos a estos altos niveles de campos magnéticos. Sin embargo, el informe también dice que las deficiencias metodológicas y sesgos en estos estudios probablemente hayan hecho que el riesgo sea exagerado.12 No se ha demostrado evidencia de una relación con la leucemia u otro tipo de tumor maligno en los adultos.12 Dado que la exposición a tales niveles de ELF es relativamente poco común, la Organización Mundial de la Salud concluye que la exposición de ELF, que sólo representan de 100 a 2400 casos en todo el mundo cada año, lo que representa 0,2 a 4,95% de la incidencia total para ese año.13
Diagnóstico
El diagnóstico se basa generalmente en repetidos conteos sanguíneos completos y un examen de médula ósea tras los síntomas observados. La biopsia de un ganglio linfático puede realizarse también para diagnosticar ciertos tipos de leucemia en algunas situaciones. Una vez diagnosticada la enfermedad, una analítica sanguínea puede utilizarse para determinar el grado de daño al hígado y a los riñones o los efectos de la quimioterapia en el paciente. Para observar los posibles daños visibles debidos a la leucemia, se pueden utilizar radiografías (en huesos), resonancia magnética (cerebro) o ultrasonidos (riñón, bazo e hígado). Las tomografías computarizadas rara vez se utilizan para revisar los nódulos linfáticos en el pecho.Si bien algunas leucemias tienen carácter fulminante, otras pueden ser enfermedades indolentes, de presentación insidiosa. Ya que no existe ningún síntoma que por sí solo y de manera específica permita diagnosticar esta enfermedad, siempre debe descartarse la presencia de leucemia en presencia de manifestaciones clínicas sugerentes, tales como un hemograma alterado. El método más seguro para confirmar o descartar el diagnóstico es mediante la realización de un mielograma y, sólo en casos seleccionados, puede ser necesario realizar una biopsia de la médula ósea.
cáncer
Saltar a: navegación, búsqueda
|
|
Este artículo o sección necesita referencias que aparezcan en una publicación acreditada, como revistas especializadas, monografías, prensa diaria o páginas de Internet fidedignas. Puedes añadirlas así o avisar al autor principal del artículo en su página de discusión pegando: {{subst:Aviso referencias|Cáncer}} ~~~~ |
|
|
Este artículo o sección tiene un nivel técnico muy alto para lectores que no son expertos en el tema. Si puedes, por favor edítalo y contribuye a hacerlo más accesible para el público general, sin eliminar los detalles técnicos que interesan a los especialistas. |
Para otros usos de este término, véase Cáncer (desambiguación).
| Cáncer | |
|---|---|
 Un TAC coronal mostrando un cáncer en la cavidad pulmonar. Leyenda: → tumor ←, ★ derrame pleural central, 1 & 3 pulmones, 2 columna vertebral, 4 costillas, 5 aorta, 6 bazo, 7 & 8 riñones, 9 hígado. |
|
| Clasificación y recursos externos | |
| CIE-10 | D00 |
| CIE-9 | 140—239 |
| CIAP-2 | A79 |
| DiseasesDB | 28843 |
| MedlinePlus | 001289 |
| MeSH | D009369 |

A diferencia de las células no cancerosas, las células con cáncer evitan la muerte celular, llamada apoptosis.
El cáncer puede afectar a todas las edades, incluso a fetos, pero el riesgo de sufrir los más comunes se incrementa con la edad. El cáncer causa cerca del 13% de todas las muertes. De acuerdo con la Sociedad Americana del Cáncer, 7,6 millones de personas murieron de cáncer en el mundo durante 2007.
El cáncer es causado por anormalidades en el material genético de las células. Estas anormalidades pueden ser provocadas por distintos agentes carcinógenoss, como la radiación (ionizante, ultravioleta, etc), de productos químicos (procedentes de la industria, del humo del tabaco y de la contaminación en general, etc) o de agentes infecciosos(virus del papiloma humana, del linfoma de Burkitt). Otras anormalidades genéticas cancerígenas son adquiridas durante la replicación normal del ADN, al no corregirse los errores que se producen durante la misma, o bien son heredadas y, por consiguiente, se presentan en todas las células desde el nacimiento (causando una mayor probabilidad de desencadenar la enfermedad). Existen complejas interacciones entre el material genético y los carcinógenos, un motivo por el que algunos individuos desarrollan cáncer después de la exposición a carcinógenos y otros no. Nuevos aspectos de la genética del cáncer, como la metilación del ADN y los microARNs, están siendo estudiados como importantes factores a tener en cuenta por su implicación.
Las anormalidades genéticas encontradas en las células cancerosas pueden ser de tipo mutación puntual, translocación, amplificación, deleción, y ganancia/pérdida de todo un cromosoma. Existen genes que son más susceptibles a sufrir mutaciones que desencadenen cáncer. Esos genes, cuando están en su estado normal, se llaman protooncogenes, y cuando están mutados se llaman oncogenes. Lo que esos genes codifican suelen ser receptores de factores de crecimiento, de manera que la mutación genética hace que los receptores producidos estén permanentemente activados, o bien codifican los factores de crecimiento en sí, y la mutación puede hacer que se produzcan factores de crecimiento en exceso y sin control.
El cáncer es generalmente clasificado según el tejido a partir del cual las células cancerosas se originan. Un diagnóstico definitivo requiere un examen histológico, aunque las primeras indicaciones de cáncer pueden ser dadas a partir de síntomas o radiografías. Muchos cánceres pueden ser tratados y algunos curados, dependiendo del tipo, la localización y la etapa o estado en el que se encuentre. Una vez detectado, se trata con la combinación apropiada de cirugía, quimioterapia y radioterapia. Según investigaciones, los tratamientos se especifican según el tipo de cáncer y, recientemente, también del propio paciente. Ha habido además un significativo progreso en el desarrollo de medicamentos que actúan específicamente en anormalidades moleculares de ciertos tumores y minimizan el daño a las células normales. El diagnóstico de cáncer en pacientes está, en gran medida, influenciado por el tipo de cáncer, así como por la etapa o la extensión de la enfermedad (frecuentemente en estados iniciales suele ser confundido con otras patologías si no se realizan los diagnósticos diferenciales adecuados). La clasificación histológica y la presencia de marcadores moleculares específicos pueden ser también útiles en el diagnóstico, así como para determinar tratamientos individuales.
Índice |
Conceptos semejantes al cáncer
Neoplasia
El término neoplasia: significa de acuerdo a sus raíces etimológicas: "tejido de nueva formación"."Neoplasia" se aplica generalmente a los tumores malignos (proliferaciones de células con comportamiento rebelde); aunque puede emplearse de manera genérica, donde significará simplemente "tumor".
Las enfermedades o lesiones cuyos nombres tienen el sufijo oma indican neoplasia, como por ejemplo adenoma, osteosarcoma, leiomioma, lipoma, melanoma, etc.
Existen, en resumen, dos tipos de neoplasias, que son las benignas o tumores benignos y las malignas o cáncer (neoplasias rebeldes).
Tumor
Inicialmente, el término tumor, se aplicó a la tumefacción, hinchazón, "bulto" o aumento localizado de tamaño, en un órgano o tejido. Incluso, el concepto aún se aplica cuando se dice que los cuatro signos cardinales de la inflamación son "tumor, dolor, calor y rubor". Con el transcurso del tiempo se olvidó el sentido no neoplásico de la palabra tumor y en la actualidad el término es el equivalente o sinónimo de neoplasia; y por lo tanto, se dice que hay tumores benignos y malignos.Cáncer
La palabra cáncer deriva del latín, y como la derivada del griego karkinos (καρκίνος), significa 'cangrejo'. Se dice que las formas corrientes de cáncer avanzado adoptan una forma abigarrada, con ramificaciones, que se adhiere a todo lo que agarra, con la obstinación y forma similar a la de un cangrejo marino, y de ahí deriva su nombre. Se considera a veces sinónimo de los términos 'neoplasia' y 'tumor'; sin embargo, el cáncer siempre es una neoplasia o tumor maligno.La palabra cáncer, sinónimo de carcinoma, se aplica a las neoplasias malignas que se originan en estirpes celulares de origen epitelial o glandular y no a las que son generadas por células de estirpe mesenquimal (sarcomas). También se excluyen los tumores de la sangre -es decir, de la médula roja de los huesos- de los ganglios y otros órganos linfáticos y del Sistema Nervioso Central. Los cánceres o carcinomas de mama suponen más del 90% de los tumores malignos de las mamas, pero al menos nueve de cada diez tumores o bultos de las mamas no son malignos.
Oncología
El término oncología proviene del griego "onkos", tumor. Es la parte de la medicina que estudia los tumores o neoplasias, sobre todo malignos.Nomenclatura del cáncer
Todos los tumores, benignos y malignos, tienen dos componentes básicos en su estructura:- Las células neoplásicas proliferantes, es decir, las células que forman el tumor propiamente dicho, que constituyen el parénquima.
- Su estroma de sostén, constituido por tejido conectivo y vasos sanguíneos. Se trata de tejidos no tumorales cuya formación ha sido inducida por el propio tumor.
Según el comportamiento de los tumores:
- Tumores benignos: Su nombre acaba en el sufijo -oma; simplemente, y según el origen del tejido del que procedan los tumores benignos, pueden ser: fibroma (tejido conjuntivo fibroso), mixoma (tejido conjuntivo laxo), lipoma (tejido adiposo), condroma (tejido cartilaginoso), osteoma (tejido óseo), hemangioma (vasos sanguíneos), linfangioma (vasos linfáticos), meningioma (meninges), tumor glómico (tejido nervioso de sostén), leiomioma (tejido muscular liso), rabdomioma (tejido muscular estriado), papiloma (tejido epitelial formando papilas), adenoma (tejido glandular), teratoma (células totipotenciales), nevus (melanocitos)
- Algunos de los tumores benignos derivados de tejido epitelial terminan con el sufijo "adenoma" porque el tejido epitelial de origen forma glándulas, si bien tenemos que tener en cuenta que existen múltiples excepciones a las normas de nomenclatura tumoral. Por ejemplo: El tumor benigno de melanocitos se denomina Nevus o nevo, y su forma maligna, Melanoma.
- Tumores malignos o cáncer:
- Los cánceres que derivan de los tejidos mensenquimatosos o mesodermo se denominan sarcomas (del griego sarcos, "carnoso"); por ejemplo: fibrosarcoma, mixosarcoma, liposarcoma, condrosarcoma, osteosarcoma, angiosarcoma, lifangiosarcoma, sinoviosarcoma, leiomiosarcoma, rabdomiosarcoma.
- Las neoplasias malignas de origen epitelial, derivadas de cualquiera de las tres capas germinales del embrión, se denominan carcinomas; por ejemplo: carcinoma epidermoide o escamoso, carcinoma basocelular, adenocarcinoma, cistoadenocarcinoma, coriocarcinoma, carcinoma de pene.
- Los tumores que proceden del tejido nervioso son los gliomas (realmente no se trata de un tumor derivado de células nerviosas, sino de uno de los tipos celulares encargados de su sostén, las células gliales, el tejido "conectivo" del cerebro, por así decir).
- Los cánceres hematológicos son los linfomas y las leucemias, siempre malignos (derivados del tejido linfoide y el mieloide respectivamente).
- Los tumores malignos que no cumplen las reglas anteriores y acaban en -oma, son: el melanoma, el hepatoma, el seminoma. También están los mesoteliomas, que se originan en las membranas serosas (pleura, pericardio, peritoneo), y que pueden tener componente epitelial o mesenquimatoso.
Epidemiología del cáncer
Los siguientes son algunos datos epidemiológicos del cáncer:- Frecuencia: El cáncer es la segunda causa principal de muerte, detrás de las enfermedades cardiovasculares. Sin embargo, los fallecimientos por estas últimas están disminuyendo, mientras que las muertes por cáncer están aumentando. Se estima que a lo largo del siglo XXI el cáncer será la principal causa de muerte en los países desarrollados. A pesar de esto, se ha producido un aumento en la supervivencia de los pacientes con cáncer.
- Para conocer los casos nuevos de cáncer que se diagnostican en una población a o largo de un periodo de tiempo, se utilizan los denominados registros poblacionales de cáncer, los cuales se ocupan de recoger de una forma sistemática, continuada y estandarizada la información necesaria para obtener datos de incidencia de cáncer y estudiar su distribución por edad, sexo, características tumorales, así como su evolución a lo largo del tiempo.
- Causa del cáncer: No se sabe de una causa única y específica, pero se conocen muchos factores de riesgo que precipitan su aparición o predisponen a ella. El principal factor de riesgo es la edad o el envejecimiento, ya que dos terceras partes de todos los casos de cáncer ocurren a cualquier edad. El segundo factor de riesgo es el tabaquismo, y los siguientes son: la dieta, el sedentarismo físico, la exposición solar y otros estilos de vida. Sea como fuera, no es posible pensar en el cáncer como una enfermedad de causa única, sino más bien como el resultado final de una interacción de múltiples factores, entre los cuales se incluyen el medio ambiente, los hábitos alimenticios, la herencia genética, etc. En la actualidad se realizan infinidad de estudios epidemiológicos que tratan de buscar asociaciones de toda índole con el cáncer. Así, por ejemplo, para discernir entre genética y ambiente (véase lo relativo a natura-nurtura), existen estudios que comparan la incidencia de distintos tipos de cáncer en una población de origen con la incidencia de los mismos en una población emigrante en otro ambiente (cáncer de estómago en Japón con cáncer de estómago en sucesivas poblaciones de emigrantes japoneses en Estados Unidos, por dar un ejemplo).
Morfología del cáncer
Las células tumorales tienen una morfología alterada que depende de la diferenciación y de la anaplasia.- La diferenciación celular de un tumor es el grado en el que las células cancerosas se asemejan a las células no cancerosas de las que proceden, tanto morfológica como funcionalmente. Las células sanas que constituyen el organismo están muy diferenciadas, lo que les permite realizar funciones específicas. Generalmente, los tumores benignos son bien diferenciados y los tipos de cáncer varían desde los muy diferenciados hasta los indiferenciados. Un grado de diferenciación bajo indica que las células tumorales son muy diferentes a lo que deberían ser para desarrollar las funciones habituales en el organismo.
- La anaplasia es la ausencia de diferenciación que conlleva a una falta de especialización o de función celular y, generalmente, cuanto más indiferenciado sea un cáncer, más alta es su velocidad de crecimiento. En general, lo que diferencia un cáncer maligno de otro benigno, es la capacidad que poseen sus células de lograr una trasvasación exitosa (o metástatizar), que se define como la capacidad que posee una célula tumoral de infiltrarse al torrente sanguíneo (o linfático), mediante la ruptura de moléculas de adhesión celular que sujetan a las células a la membrana basal, con posterior destrucción de esta última. Esta característica que se adquiere luego de sucesivas alteraciones en el material genético celular, donde es común observar cromosomas fragmentados, pérdida de genes supresores de tumores (como el p53 o el bcl3), receptores de señales mutados autoinductivos (etapa avanzada de diferenciación), es la que origina el proceso de metástasis; es decir, la invasión y destrucción de tejidos. Dicho proceso de trasvasación posee una escasa eficiencia, que es del orden de 1 en 10.000 casos. La baja eficiencia se debe principalmente a la actividad del sistema inmunitario.
En conclusión, según recientes trabajos de investigación, en general, una única mutación en el material genético celular no es la responsable de transformar a una célula sana en cancerosa; por el contrario, se requieren múltiples mutaciones (que a la postre suelen degenerar en aberraciones cromosómicas), las cuales son generadas ya sea por sucesivos ciclos replicativos o por factores externos inductores de la carcinogénesis (químicos, físicos y/o biológicos); en donde exista algún daño específicamente en la secuencia de exones de protooncogenes y de genes supresores de tumores, que son los encargados de regular el ciclo celular y la muerte celular programada (apoptosis) respectivamente [en un lenguaje menos académico la apoptosis es comparable a un suicidio, con el fin de preservar la integridad celular del tejido conservando en el mismo solo células sanas]. Cualquier otra mutación desencadenará en la transcripción de genes p53, p21 y p16 responsables, entre otros, de la apoptosis. De esta manera, es posible entonces establecer una relación entre envejecimiento y cáncer por las causas mencionadas, dado a que la mayor parte de los pacientes que padecen cáncer tienen edades avanzadas, aunque existen patologías cancerosas típicamente puerperiles, juveniles o del adulto joven. En etapas tempranas, donde existe una bajo nivel de diferenciación de estas células, se observa que la frecuencia de replicación es ligeramente mayor a la esperada; pero, aún en estas condiciones, las células siguen cumpliendo con las funciones normales propias del tejido. Luego, en estados más avanzados, es posible detectar cambios en la bioquímica celular, donde aparecen enzimas y proteínas que no son propias del tipo celular, como nuevas proteínas canal (usualmente son las responsables de evacuar selectivamente altas concentraciones de quimioterápicos, y por ende de generar resistencia a los mismos), presencia de telomerasa, gradiente continuo (patológico) de segundos mensajeros intracelulares que participan en la transducción de señales, secuencias promotoras del ADN dañadas, etc.
Crecimiento tumoral
El crecimiento tumoral tiene las siguientes características:- Acelerado por un aumento de la división celular que hace que las células tumorales se encuentran en continuo ciclo celular con un exceso de proliferación celular.
- Descontrolado, debido a que no se deja influir por los factores de crecimiento ni otros estímulos externos.
Invasión local
La invasión es la capacidad que tienen las células tumorales de infiltrar o penetrar en los tejidos normales y en los vasos sanguíneos, y de ahí empezar la metástasis. La invasión es debida a:- Angiogénesis o neovascularización: Es la capacidad de formar nuevos vasos sanguíneos por medio de la secreción de factores de crecimiento, como el factor de crecimiento del endotelio vascular (VEGF). Los nuevos vasos son indispensables para la nutrición de las células tumorales y de las metástasis.
- Adherencia celular: Es el anclaje de la célula tumoral por medio de la adquisición de receptores específicos a la membrana basal y a la matriz extracelular. Estos receptores son para integrinas, MAC y caderinas.
- Proteolisis: Es la destrucción de la membrana basal y de la matriz celular mediante la secreción de enzimas, como las colagenasas, que destruyen el colágeno, y así poder abrirse camino entre estas estructuras.
- Movilidad: Es la migración o locomoción de las células malignas a través de la matriz celular para llegar a un vaso sanguíneo o linfático, intravasarse, ser transportadas por la corriente sanguínea hasta lechos capilares distantes, extravasarse, y migrar una cierta distancia para iniciar la formación de una nueva colonia (metástasis, es decir, implantes tumorales malignos con las mismas características).
Biología molecular del cáncer
La transformación maligna de las células normales consiste en la adquisición progresiva de una serie de cambios genéticos específicos que actúan desobedeciendo los fuertes mecanismos antitumorales que existen en todas las células normales. Estos mecanismos incluyen:- La regulación de la transducción de señales.
- La diferenciación celular.
- La apoptosis.
- La reparación del ADN.
- La progresión del ciclo celular.
- La angiogénesis.
- La adhesión celular.
Carcinogénesis
La carcinogénesis es la formación del cáncer por medio de los carcinógenos o de enfermedades genéticas.Genética del cáncer
El cáncer es una enfermedad genética producida por la mutación de determinados genes en una célula determinada, que adquiere las características del cáncer. Estos genes son de tres tipos:- Oncogenes: Son genes mutados que promueven la división celular, procedentes de otros llamados protooncogenes(los cuales tienen una función normal), encargados de la regulación del crecimiento celular. Su herencia sigue un patrón autosómico dominante. Suelen ser receptores de membrana (hormonas y otros factores). Hay más de 100 oncogenes descritos.
- Genes supresores tumorales: Son los encargados de detener la división celular y de provocar la apoptosis. Cuando se mutan estos genes la célula se divide sin control. Suelen ser factores de control transcripcional y traduccional. Cuando pierden su función normal (por deleción, translocación, mutación puntual)se originan tumores.
- Genes de reparación del ADN: Cuando el sistema de reparación es defectuoso como resultado de una mutación adquirida o heredada, la tasa de acumulación de mutaciones en el genoma se eleva a medida que se producen divisiones celulares. Según el grado en que estas mutaciones afecten a oncogenes y genes supresores tumorales, aumentará la probabilidad de padecer neoplasias malignas.
Naturaleza clonal del cáncer (teoría monoclonal)
Los cánceres se originan a partir de una célula única, tras la suma de múltiples mutaciones (de cinco a diez) en el genotipo para que se transforme en un fenotipo maligno en el transcurso de varios años, dando lugar a un clon de células, que es el tumor.Actualmente se acepta la teoría de Sell y Pierce, que promueve que la mutación, iniciación y la transformación maligna ocurre en la célula progenitora o "stem cell", debido a un bloqueo de su maduración. Las mutaciones en células somáticas no resultarían en cáncer, ya que son células maduras con vida corta y que normalmente van a la apoptosis antes que nuevas mutaciones puedan desdiferenciarlas.
La agresividad y poder metastásico del tumor va a depender de la etapa de maduración celular en que se produce la mutación. Los tumores derivados de una célula madre en maduración precoz metastizarán rápidamente y tendrán un fenotipo más heterogéneo. Aquellos derivados de una célula madre en etapa más tardía serán menos metastizantes y de fenotipo más homogéneo.
Diagnóstico del cáncer
Biopsia
El diagnóstico del cáncer se basa en la biopsia del tumor para un estudio histológico, con grado de diferenciación y de invasión, y para un estudio molecular que determine sus marcadores biológicos y genéticos.Test Molecular de marcadores específicos de tejido
Se analizan las características moleculares del tejido originario del tumor. Aunque su detección no implica necesariamente la presencia de un cáncer, se ha encontrado relación entre ciertos tipos de cáncer y la localización anormal de determinadas moléculas en el tejido estudiado, como por ejemplo:- Citoqueratinas en cáncer de estómago.
- Antígeno carcinoembrionario en cáncer de mama.
- Reorganizaciones de inmunoglobulinas o receptores de células T
Test Molecular de marcadores específicos de tumor
Consiste en el estudio de marcadores que no se expresan habitualmente en una célula normal. Se pueden estudiar marcadores genómicos, cromosómicos o anomalías génicas en oncogenes o genes supresores de tumores. Son pruebas más definitivas que las anteriores, pues en todos los tipos de tumores se encuentran mutaciones y translocaciones.Algunos de los marcadores más estudiados son:
- HER2: receptor 2 del factor de crecimiento epidérmico humanos, perteneciente a las familias de las tirosinas kinasas. Es un oncogén localizado en el brazo largo del cromosoma 17 (17q21.1). Es esencial para el crecimiento y división de las células normales, pero se ha relacionado el cáncer de mama con una sobreexpresión del 25-30% del gen HER2/neu/ERBB2. Se puede analizar mediante estudios de:
-Estudios de hibridación: Western blot, Northern blot y Souther blot. De esta forma se correlaciona la sobreexpresión del gen con su amplificación.
-FISH para detectar el número de copias del gen. Se puede usar también un CISH como alternativa más económica, aunque de mucha menor calidad.
- EGFR: receptor 1 del factor de crecimiento epidérmico en humanos, también llamado HER1. Se encuentra en el brazo pequeño del cromosoma 7 (7p12) y también pertenece a la familia de las tirosinas kinasas. Algunos de los tratamientos contra el cáncer (Herceptin,Cetuximab) que usan anticuerpos contra estas proteínas sobreexpresadas. Otros tratamientos(Erlotinib) son inhibidores de la actividad tirosina kinasa específica.
- Genes Ras: codifican para proteínas que forman parte de la cascada de fosforilación desde la tirosina kinasa hasta la kinasa mitogénica. Las mutaciones en K-Ras (12p12) son las más comunes en los cánceres humanos. Se encuentran en los codones 12, 13, 22 y 61 del gen y codifican la región que se une a GTP, dejando la proteína activa permanentemente (se activan con la unión de GTP). Dichas mutaciones se pueden analizar mediante SSCP, secuenciación directa, pirosecuenciación, biochips.
- Fusión EWS/FLI presente en el 85% de los casos de Sarcoma de Ewing. Es un cáncer agresivo principalmente de hueso causado por la traslocación entre los cromosomas 11 y 22, el cual fusiona el gen EWS del cromosoma 22 con el gen FLI1 del cromosoma 11. La proteína de fusión resultante se puede detectar por inmunohistoquímica. También se puede estudiar la mutación mediante RT-PCR usando un cebador para el gen EWS y otro para el gen a estudiar (FLI en esta fusión), detectándose un producto de mayor tamaño en caso de que se haya producido la fusión, pues se amplifica una región de mayor tamaño. Otra forma de detección de la fusión sería haciendo un FISH, usando dos sondas que hibriden en el gen EWS que se observarán separadas en caso de translocación.
- TP53(17p13): se encuentra en todos los tipos de cáncer y la mitad de los tumores presentan mutaciones en p53. Se trata de una proteína de unión a ADN reguladora, que participa en la detención del ciclo celular cuando se encuentran daños en el ADN. Puede llegar a inducir apoptosis si los daños son excesivos. Puede ser degradado por MDM2. Los mutantes p53 acumulan mutaciones, pues no funciona su mecanismo de control del ciclo celular, que pueden desembocar en cáncer. Por lo tanto, dichas mutaciones son de mal pronóstico. Para detectar las mutaciones se usan técnicas de inmunohistoquímica, SSCP y secuenciación.
- Gen ATM(11q22): codifica para una fosfatidil inositol quinasa implicada en la reparación de daños en el ADN y control del ciclo celular. Mutaciones en este gen causan la Ataxia-Telangiectasia y predisponen a sufrir cáncer. También provoca inmunodeficiencias: leucemias y linfomas. Las mutaciones se pueden detectar mediante secuenciación completa del gen, SSCP o mediante un test funcional (se irradia un cultivo celular, se añade colchicina y se analizan los cariotipos para calcular las anomalías por célula).
- Pérdida de heterocigosidad(LOH): pérdida en el tumor de la copia correcta del gen. Se estudia mediante la amplificación de marcadores ligados a los alelos de interés.
Estadificación del cáncer
Determina la extensión de la enfermedad basada en que el cáncer se extiende en tres niveles que son el local, regional y a distancia. Existen dos tipos de estadificción:- La estadificación clínica basada en la exploración física, las radiografías, el TAC, la RMN, la gammagrafía y otras técnicas de imagen.
- La estadificación anatomopatológica o quirúrgica que consiste en el análisis histológico de todos los tejidos extirpados durante la cirugía, durante la extirpación definitiva del tumor primitivo, o como un procedimiento aparte de estadiaje.
Gradación y Estadificación
La gradación se usa para clasificar las células cancerosas en cuanto a su diferencia de las células normales cuando se ven al microscopio y a la rapidez probable de diseminación del tumor. El grado histológico, también llamado diferenciación, se refiere a la semejanza que tengan las células del tumor con las células normales del mismo tipo de tejido.Grado:
- GX No es posible asignar un grado (Grado indeterminado).
- G1 Bien diferenciado (Grado bajo).
- G2 Moderadamente diferenciado (Grado intermedio).
- G3 Mal diferenciado (Grado alto).
- G4 Indiferenciado (Grado alto).
Tamaño del Tumor
- TX El tumor primario no puede ser evaluado.
- T0 No hay evidencia de tumor primario.
- Tis Carcinoma in situ (cáncer inicial que no se ha diseminado a tejidos vecinos)
- T1, T2, T3, T4 Tamaño y/o extensión del tumor primario.
- NX No es posible evaluar los ganglios linfáticos regionales
- N0 No existe complicación de ganglios infáticos regionales (no se encontró cáncer en los ganglios linfáticos).
- N1, N2, N3 Complicación de ganglios linfáticos regionales (número y/o extensión de diseminación).
- MX No es posible evaluar una metástasis distante.
- M0 No existe metástasis distante (el cáncer no se ha diseminado a otras partes del cuerpo).
- M1 Metástasis distante (el cáncer se ha diseminado a partes distantes del cuerpo).
- Sitio del tumor primario.
- Tamaño y número de tumores.
- Complicación de ganglios linfáticos (diseminación del cáncer a los ganglios linfáticos).
- Tipo de célula y grado del tumor (qué tanto se parecen las células cancerosas al tejido normal).
- Presencia o ausencia de metástasis.
Tratamiento del cáncer
El tratamiento del cáncer se fundamenta en tres pilares: cirugía, quimioterapia y radioterapia. Existe un cuarto pilar llamado terapia biológica que incluiría la hormonoterapia, inmunoterapia, y nuevas dianas terapéuticas no citotóxicas. El tratamiento del cáncer es multidisciplinar donde la cooperación entre los distintos profesionales que intervienen (cirujanos, oncólogos médicos y oncólogos radioterápicos), es de máxima importancia para la planificación del mismo; sin olvidar el consentimiento informado del paciente. En todo momento, el apoyo emocional es fundamental y la búsqueda de los posibles detonantes psicoemocionales o psicobiológicos.A veces, dada la incapacidad actual de la ciencia para curar los tipos de cáncer más agresivos en estados avanzados de evolución, es preferible renunciar al tratamiento curativo y aplicar un tratamiento paliativo que proporcione el menor grado posible de malestar y conduzca a una muerte digna. En estos casos el apoyo emocional cobra una importancia primordial.
En el plan de tratamiento hay que definir si la intención es curativa o paliativa.
La respuesta al tratamiento puede ser:
- Completa: Si se ha producido la desaparición de todos los signos y síntomas de la enfermedad.
- Parcial: Si existe una disminución mayor del 50% en la suma de los productos de los diámetros perpendiculares de todas las lesiones mensurables.
- Objetiva: Es la respuesta completa o parcial.
- Progresión: Si aparece cualquier lesión nueva o existe un aumento mayor del 25% en la suma de los productos de los diámetros perpendiculares de todas las lesiones mensurables.
- Estable: Si existe crecimiento o reducción del tumor que no cumple ninguno de los criterios anteriores.
Aspectos emocionales
La búsqueda de los aspectos psicoemocionales o psicobiológicos que han podido generar la alteración cerebral que originó la formación del cáncer es prioritaria. Si se desconoce esto, lamentablemente, es frecuente que cuando diagnostican a una persona con cáncer, puede sufrir estrés y otras reacciones por su efecto nocivo, que van a agravar el cuadro clínico, debilitando su sistema inmunitario, y generando efectos iatrogénicos (debido al médico y a su tratamiento). Estas sensaciones pueden hacer que resulte difícil que el paciente piense en todo lo que desea preguntar a su profesional de salud. A menudo, el hacer una lista de preguntas de antemano ayuda en esta tarea. También, ayuda recordar lo que dice el especialista, los pacientes pueden tomar notas o preguntar si pueden utilizar una grabadora. Hay personas que tienen un familiar o un amigo con ellos cuando hablan con el especialista. Los pacientes no deben sentir la necesidad de hacer todas sus preguntas o de recordar todas las respuestas en una sola vez. Tendrán otras ocasiones de pedir que su profesional de salud explique cosas y consiga más información.El impacto del diagnóstico y tratamiento del cáncer provoca una serie de respuestas psiconeuroinmunológicas, psicobiológicas y psicosociales que afectan a la calidad de vida del paciente. El trabajo Diferencias en la calidad de vida: Un estudio longitudinal de pacientes de cáncer recibiendo tratamiento de quimioterapia. de Terol, López-Roig, Rodríguez-Marín, Pastor, Mora, Martín-Aragón, Ignacio Leyda, Neipp y Lizon, fue evaluar y comparar la calidad de vida y el Estado emocional, (ansiedad y depresión) de 21 pacientes oncológicos entrevistados en dos momentos de su enfermedad, al inicio y en sus últimos ciclos de quimioterapia. Los resultados mostraron que la calidad de vida global y la condición física percibida se asociaron entre sí y con la depresión. Sólo la Condición Física se diferenciaba significativamente entre las fases de estudio. En ambas fases, los Síntomas de Enfermedad, y el Impacto Económico se asociaron, bien con la ansiedad o con la depresión. El Impacto Social se relacionó con la depresión y la ansiedad en la primera fase, y la Discapacidad funcional con la Calidad de vida global, en la segunda.
Al hablar de opciones del tratamiento, el paciente puede preguntar para participar en un estudio o investigación. Tales estudios, llamados ensayos clínicos, se diseñan para mejorar el tratamiento del cáncer.
El tratamiento de los pacientes se escoge entre el paciente (cada paciente es distinto) y la eficacia de ese tratamiento. Es importante recordar, sin embargo, que las estadísticas son promedios basados en una gran cantidad de pacientes. Los pacientes pueden desear hablar con el doctor sobre la recuperación (pronóstico). Cuando los doctores hablan de cáncer el hecho de sobrevivir puede ser el objetivo más que la curación del paciente.
Conseguir una segunda opinión. Las decisiones del tratamiento son complejas. A veces es bueno que los pacientes tengan una segunda opinión sobre la diagnosis y el plan de tratamiento (algunas compañías de seguros requieren una segunda opinión; otras pueden pagar una segunda opinión si el paciente la solicita). Hay varias maneras de encontrar otro doctor a consultar:
El doctor del paciente puede poder sugerir un especialista. Los especialistas que tratan esta enfermedad incluyen a psicólogos, gastroenterologistas, cirujanos, médicos oncologistas y a oncologistas de la radiación.2
Pronóstico del cáncer
Ningún médico puede estar completamente seguro de que el paciente que atiende se vaya a curar. Las posibilidades de una persona dependen primordialmente, de lo temprano que se haya descubierto la enfermedad, pero también del tipo de cáncer, pues algunos son más agresivos que otros. Otro factor que interviene es la condición física del paciente; es muy importante que su forma física sea buena, y la disposición hacia su enfermedad, ya que debe afrontarla y ayudar con su estado de ánimo a curarla.A partir de la década de 1990 y con las técnicas terapéuticas disponibles, el cáncer es curable en aproximadamente el 50% de los pacientes diagnosticados. El pronóstico del cáncer depende sobre todo de:
- La localización del tumor primario.
- El tipo histológico con su grado de diferenciación celular, sus características biológicas y citogenéticas.
- El estado del cáncer o extensión de la enfermedad.
- La edad del paciente.
- El estado funcional o la reserva fisiológica del paciente.
Prevención del cáncer
Aunque la causa del cáncer es desconocida en muchos casos y multifactorial en otros, se conocen unos factores de riesgo, que aumentan la probabilidad de padecer cáncer y que deberían evitarse, como por ejemplo el tabaquismo o todo otro modo de fumar. Se estima que hasta un 50% de los cánceres podrían ser evitables.Existe una vacuna recientemente aprobada contra el cáncer de cuello de útero. La comercialización de esta vacuna fue aprobada en varios países y se estudia la aprobación de otras vacunas contra el cáncer de piel y el cáncer de próstata[cita requerida].
Prevención primaria
Es la detección del cáncer en individuos asintomáticos, con el objetivo de disminuir la morbilidad y la mortalidad.- Educación y hábitos saludables:
- Dejar de fumar: salva y prolonga la vida más que cualquier actividad de Salud Pública. Además del tabaco con su nicotina, prácticamente todo humo que se inhala frecuentemente posee elementos carcinógenos (por ejemplo: el alquitrán es un carcinógeno que se encuentra en diversas sustancias fumables).
- Dieta saludable: en tal sentido se recomienda que sea variada, con la suficiente cantidad de nutrientes (en especial vitaminas y elementos como los fitoesteroles, azufre, selenio y ácidos grasos esenciales como el Omega 3 y nunca el omega 6 por ser pro inflamatorio y por tanto favorecedor del desarrollo tumoral), por este motivo se recomienda el consumo de alimentos orgánicos en particular repollos o coles, coliflores, brecoles o brocolis; frutas ricas en vitamina C, granada, tomate, almendra, los cítricos (por ejemplo la cáscara de mandarina posee salvesterol Q40 compuesto con propiedades anticarcinógenas) y los alimentos ricos en fibra — como el pan integral— facilitan el tránsito intestinal y así la eliminación de toxinas, lo mismo hace el consumo de más de un litro de agua potable por día (el agua potable debe estar libre o poseer solo ínfimas cantidades de arsénico).
También otro cambio de alimentación importante, además del citado con los ácidos grasos, ocurre con el azúcar, y los monosacaridos en general añadidos a la alimentación industrial y refrescos. La entrada de azúcar en sangre provoca la acción de la insulina y el IGF1. Niveles elevados de insulina e IGF1 incrementan la incidencia de cáncer. Por eso son aconsejables los carbohidratos complejos y ricos en fibra, y se ha de evitar el pan blanco, refrescos, hamburgesas, etc, que además de cáncer predisponen a diabetes mellitus y obesidad y las comorbilidades asociadas. En general, debemos cambiar el modelo de alimentación por completo, y de preferencia alimentarse de agricultura ecológica libre de pesticidas y de ganado alimentado con exceso de omega 6. Es también reseñable la falta de formación de oncólogos en alimentación para minimizar en lo posible la inflamación y estimular el sistema inmune, por lo que sería deseable la entrada de nutricionistas especializados en oncología en la sanidad española.
Se consideran muy nocivas las fast foods en especial las que poseen ciclamato de sodio o sacarina como "endulzantes", así como las abundantes en nitratos (tal como ocurre con los hot dogs), tampoco resulta conveniente el demasiado consumo de azúcar, del mismo modo resultan nocivos los alimentos contaminados por micotoxinas (por ejemplo aflatoxinas). Se recomienda mucho el consumo del aceite de oliva virgen y extravirgen pero se desaconseja el "aceite de oliva" de tercer refinado; son nocivas las grasas hidrogenadas y las grasas trans. Se desaconseja absolutamente el uso de aceite refrito y el comer frecuentemente los alimentos parcial o totalmente quemados. También tienen compuestos carcinógenos de efectos nocivos, si el consumo es crónico, los alimentos ahumados. Se desaconseja el consumo asiduo de bebidas alcohólicas: existe una cierta tolerancia del cuerpo humano a dosis moderadas de bebidas alcohólicas fermentadas como el vino, la cerveza o la sidra pero resultan muy predispositivas a diversas formas de cáncer las bebidas alcohólicas destiladas (vodka, whisky, ginebra, etc.).
- Se cree que el consumo de vitamina B17, un agente que se encuentra en una gran cantidad de plantas y frutos, sirve para prevenir la enfermedad. Esta teoría está basada en los análisis efectuados por el Doctor Ernest Krebs.
- El exceso de consumo de grasas animales parece proclivizador para cánceres de seno.
- El escaso consumo de fibras vegetales ralentiza la actividad del tracto digestivo lo cual provoca que se acumulen toxinas en los intestinos, de modo que conviene una dieta con fibras naturales comestibles (la celulosa de los gajos de los cítricos, la celulosa presente en los panes y harinas integrales, los preparados con arroz integral —granos de arroz con su cascarilla- etc, son casi siempre benéficos.).
- Evitar la exposición prolongada al Sol (o a otras fuentes de radiaciones UV), es casi obvio que se deben evitar todo lo posible las exposiciones a otras radiaciones ionizantes como lo son los rayos x y elementos radiactivos, también se ha observado un riesgo en las microondas así como en las altas frecuencias electromagnéticas que se producen cerca de cables de alta tensión o de poderosas antenas emisoras de radio. Para una persona de tez clara en latitudes subtropicales (como ocurre en gran parte de Argentina, Australia, España, Grecia, Italia, México, sur de Estados Unidos etc.) al nivel del mar el tiempo de exposición directo diario recomendable sería de 30 minutos, luego de este plazo se hace necesario el uso de protectores contra la radiación ultravioleta. Las personas de tez clara pueden tolerar mayor asoleamiento en zonas ubicadas entre los paralelos 40° (Sur y Norte) hasta las latitudes polares...si no existen agujeros de ozono, téngase en cuenta que la radiación solar también se hace muy intensa si se superan los 1000 msnm o se potencia por reflejo en zonas cubiertas de arena, nieve, e incluso agua. Las poblaciones de tez más pigmentadas tienen mayor resistencia al efecto de la radiaciones ultravioletas pero aun así conviene siempre evitar el exceso de exposición a la radiación solar o toda fuente de UV.
- Evitar la exposición prolongada a aparatos que causen efectos de radiación (esto vale por ejemplo para la luz fluorescente y la llamada luz negra sin el adecuado filtrado).
- El sedentarismo (principalmente la falta de actividad física) y en particular el sobrepeso es proclivizador de los cánceres.
- Atender las enfermedades gastrointestinales comunes, la bacteria (Helicobacter pylori) que provoca la úlcera gástrica o úlcera péptica produce toxinas carcinógenas.
- Observar el desarrollo de lunares en especial los nevos de colores: lunares de gran tamaño o asimétricos requieren especial precaución y se sugiere su exceresis o extirpación, en cuanto a queratosis y verrugas siempre es aconsejable la consulta al médico, las verrugas raramente se malignizan aunque conviene la precaución en especial si afectan zonas genitales o zonas de frecuente rozamiento.
- Quimioprevención: Es la utilización de determinados agentes químicos, naturales o sintéticos, para revertir, suprimir o impedir la carcinogénesis antes del desarrollo de una neoplasia maligna.
- Quimioevitación: Es la evitación de determinados agentes químicos cancerígenos o de los que no se tiene la seguridad de que no provocan cáncer.
- Coherente con el punto anterior, el ambiente donde se vive o se trabaja debe estar en todo lo posible libre de elementos carcinógenos como el smog, las dioxinas, aerosoles de alquitrán, plomo, PCB, amianto exceso de ozono, o aguas contaminadas con mercurio o arsénico.
- Las prácticas sexuales deben ser seguras, muchas enfermedades de transmisión sexual pueden degenerar en cánceres (por ejemplo la hepatitis C y la hepatitis B, el virus de papiloma genital o el VIH-sida).
- La vida emotiva incide en factores anticancerígenos o, por el contrario, cancerígenos. Anticancerígeno cuando el estado anímico del individuo es alegre o de felicidad (muchas veces facilitado por las actividades físicas, las distracciones y diversiones o, incluso por el buen dormir o por la simple posibilidad de poder ver luz del día -siempre y cuando no exista un exceso en la exposición solar y menos aún en los ojos- ); o los cancerígenos cuando el estado emotivo (generalmente por angustia) bajan la capacidad del sistema inmune, entre los cuales podemos encontrar principalmente a la depresión (en especial la derivada de los duelos) y el estrés, pero ante todo, el miedo a la muerte (tanatofobia) o con tendencia a la hipocondría.
- Vacunación: Las vacunas para determinados virus, pueden prevenir determinados tipos de cáncer. Por ejemplo la vacunación universal contra la hepatitis B, puede reducir la incidencia de hepatoma.
- Se ha observado que un déficit crónico de vitamina D predispone al ser humano a ser afectado por diversos tipos de cáncer.
Suscribirse a:
Entradas (Atom)









